Количественное изменение энергии, запасенной в жировой ткани, зависит от баланса между поступлением энергии и ее расходованием. Ряд гормональных систем и отделов головного мозга регулируют как потребление, так и расходование энергии. Тесная взаимосвязь этих систем подтверждается относительным постоянством массы тела, несмотря на широко варьирующееся поступление калорий в организм.
Вентромедиальные и латеральные отделы гипоталамуса рассматриваются как комплекс интегрирующих систем, регулирующих пищевое поведение и расходование энергии. Ведущая роль гипоталамуса в регуляции пищевого поведения и расходования энергии у людей наглядно проявляется при гипоталамическом ожирении. Травматическое или инфекционное поражение гипоталамуса приводит к синдрому, характеризующемуся гиперфагией, гиперинсулинизмом и повышенной активностью парасимпатической нервной системы.
Пищевое поведение состоит из «решений» по поводу начала, количества и качества, а также завершения приема пищи; эти решения подвержены влиянию множества внешних и внутренних факторов, в том числе ряда гормонов, нейромедиаторов, а также уровней глюкозы, липидов и аминокислот плазмы крови.
Жировая ткань является инсулинзависимой. Инсулин в жировой ткани подавляет активность гормон чувствительной липазы, в результате -уменьшается высвобождение свободных жирных кислот (СЖК) и снижается их уровень в плазме крови, а также усиливает липогенез и окисление глюкозы по пентозофосфатному пути.
Расходование энергии (основной обмен, специфический термогенный эффект пищи, при физической нагрузке) находится, в основном, под влиянием эффекторных звеньев центральной гипоталамической регуляции: вегетативной нервной системы, катехоламинов, тиреоидных гормонов и др.. Катехоламины, глюкагон, АКТГ, МСГ и гормон роста ускоряют высвобождение СЖК из жировой ткани, повышая их уровень в плазме крови, и увеличивают скорость липолиза триглицеридов. Большинство указанных гормонов повышают активность липазы. Глюкокортикоиды и тиреоидные гормоны, не оказывая прямого действия на липолиз, обладают потенцирующим влиянием в отношении эффекта других гормонов.
В последние годы проведен целый ряд исследований, направленных на изучение роли самой жировой ткани в генезе ожирения и связанных с ним осложнений. Жировая ткань, помимо своей функции энергетического депо организма, является источником синтеза ряда биологически активных субстанций, обладающих эндокринным, паракринным и аутокринным действием, что позволяет считать ее эндокринным органом.
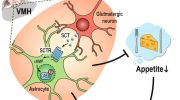
Лептин (leptos – тонкий худой, грен.) — гормон пептидной природы, секретируется адипоцитами белой жировой ткани и выполняет функцию сигнала, информирующего гипоталамус о достаточных запасах энергии в организме. Рецепторы лептина Rb локализуются в центре насыщения -вентромедиальном ядре гипоталамуса, а также в аркуатном, дорсомедиальном и паравентрикулярном ядрах. Лептин, проникая в гипоталамус и связываясь с рецептором, участвует в регуляции пищевого поведения, способствуя снижению потребления пищи и предотвращая развитие ожирения.
Считается, что регуляция пищевого поведения и поступления пищи зависит от слаженной работы 2-х типов эффекторных систем в ЦНС и гипоталамусе. Первая — анаболическая — запускается низким уровнем лептина при ограниченном поступлении жира. Основным звеном этой системы является вырабатываемый в аркуатном ядре гипоталамуса нейропептид V. Конечным результатом активации этой системы является стимулирование аппетита, поступление пищи и отложение жира.
Вторая система – катаболическая – меланокортиновая система гипоталамуса. Высокие концентрации лептина стимулируют продукцию а-меланоцитстимулирующего гормона (МСГ) из проопиомеланокортина (ПОМК) в аркуатном ядре гипоталамуса. ПОМК является также предшественником эндорфина и АКТГ. В свою очередь, МСГ, воздействуя на рецепторы типа МС4 в паравентрикулярных ядрах, вызывает секрецию кортиколиберина. Меланоцитстимулирующий гормон и кортиколиберин снижают аппетит и способствуют уменьшению массы тела.
Лептин вызывает насыщение и стимулирует тормозные сигналы, опосредованные глюкагоноподобным пептидом I и адресованные вентромедиальным центрам голода, где под влиянием лептина уменьшается выработка нейропептида, снижая тем самым поступление энергии. Также, лептин посредством стимуляции активности симпатической нервной системы и липолиза в жировой ткани может увеличивать расход энергии.
Изучение лептиновой регуляции у лиц с первичным ожирением показало, что более 80% пациентов имеют выраженную гиперлептинемию. Таким образом, резонно предположить, что у большинства людей с ожирением имеется лептинорезистентность. Точные механизмы лептинорезистентости в настоящее время неизвестны, но возможно, она является результатом нарушения прохождения лептина через гематоэнцефалический барьер, либо аномалии гипоталамических рецепторов и нарушения передачи лептинового сигнала, не исключена возможность аномалий транспортного белка лептина.
Увеличение массы тела может быть обусловлено также нарушением синтеза биологически активных субстратов периферического происхождения, участвующих в регуляции пищевого поведения. Одним из факторов, принимающих участие в регуляции аппетита, является секретируемый клетками желудка гормон — грелин. Грелин сигнализирует о голодании, способствуя повышению аппетита и увеличению приема пищи. Реципрокные взаимоотношения грелина и лептина проявляются на уровне аркуатного ядра гипоталамуса, где имеются специфические рецепторы к этим пептидам. Лептин подавляет активность нейропептид-Y-содержащих нейронов и стимулирует продукцию ПОМК, тогда как грелин оказывает противоположный эффект. У детей с избыточной массой тела уровень грелина снижен по сравнению с детьми с нормальным весом, и обратно пропорционален чувствительности к инсулину.
Исследования адипоцитов и адипоцитокинов, проведенные в последние годы, помогли объяснить ряд механизмов возникновения метаболических нарушений, связанных с ожирением (гуморальная теория). При ожирении отмечается повышение уровней секретируемых гипертрофированными адипоцитами биологически активных веществ (ФНО-а, ИАП-1, ИЛ-6, ангиотензин II и др.), способствующих развитию инсулинорезистентности (ИР), активации воспалительных реакций в сосудистой стенке, внутриклеточной адгезии моноцитов и каскада оксидативного стресса.
Предполагается, что нарушение действия лептина при ожирении может быть ведущим фактором в развитии ИР, поскольку утрачивается его важная функция – предотвращение отложения жира в периферических органах: печени, мышцах, миокарде, поджелудочной железе. В исследовании J. Sleinberger с соавт. (2003) обнаружена достоверная корреляция лептина с уровнем инсулина натощак и показателями ИР у детей с ожирением, независимо от массы жировой ткани.
Напротив, при ожирении, особенно при его висцеральной форме, снижается секреция адипонектина. Таким образом, утрачиваются его протективные эффект в отношении развития атеросклероза: уменьшение ИР за счет стимуляции фосфорилирования тирозина инсулинового рецептора, снижение продукции глюкозы печенью и синтеза триглицеридов, стимуляция окисления СЖК в мышечной ткани, противовоспалительное действие. Изменения уровней адипоцитокинов на фоне ожирения у детей полностью идентичны таковым у взрослых.
Установлено, что на 30-50% склонность к избытку жировой массы может быть обусловлена генетическими изменениями. По данным Картелишева А.В. с соавторами, проанализировавших родословные 468 пробандов, включавшие 6 788 человек, наибольшую вероятность заболеть ожирением имеет ребенок обоих родителей с избыточной массой тела (82,3%), если ожирение имеется только у матери, эта вероятность составляет 51,7%, несколько меньше – при наличии ожирения у отца – 38,9%, совсем незначительная – при отсутствии ожирения у родителей, но при наличии ее у других родственников (в том числе II степени родства) — 7,6%. Близнецовый метод показал, что масса тела наследуется с вероятностью 40-70%, при этом конкордантность у монозигот составляет 0,7-0,9, а у дизигот -0,35-0,45.
Ожирение может быть компонентом некоторых редких генетических синдромов (плейотропных) с характерными фенотипами. В качестве облигатного или факультативного признака ожирение встречается при 30-ти подобных синдромах: Прадера-Вилли, Лоренса-Муна-Барде-Бидля, Коэна, Альстрема и др. Позиционное клонирование позволило идентифицировать несколько генетических дефектов, лежащих в их основе.
К настоящему времени идентифицировано несколько моногенных синдромов с ожирением и при большинстве из них нарушен путь лептин-меланокортиновой регуляции. Среди известных генов: ген лептина, рецептора лептина, проопиомеланокортина, прогормона конвертазы 1, рецептора меланокортина MC4R, транскрипционного фактора SIMI, мутации которых, не обладая плейотропным эффектом, приводят к раннему выраженному ожирению с развитием нейроэндокринных и биохимических изменений. Однако, гомозиготные мутации данных генов являются причинами ожирения в очень редких случаях, характеризующихся типичными фенотипами с дефицитом других гормонов, что исключает роль этих генов в развитии большинства случаев обычного ожирения.
По последним опубликованным данным, более 430 генов, генетических маркеров и хромосомных участков связывается или ассоциируется с фенотипами ожирения у человека. Каждая хромосома, за исключением Y-хромосомы, имеют локусы, связанные с фенотипическим ожирением. Однако, определенные гормональные, синдромные или молекулярно-генетические нарушения могут объяснить пока только менее 1% всех случаев ожирения. Наиболее вероятно, что ожирение детского возраста является полиэтиологическим, полигенным и реализуется при сложном взаимодействии генетических и средовых факторов.
В этом разделе мы публикуем статьи и материалы по медицинской тематике, присланные нашими читателями.
Если у вас есть что-то интересное, чем бы вы хотели поделиться с другими людьми, мы будем рады разместить вашу статью на нашем сайте.
Внимание!
В случае, если присланный вами материал не соответствует тематике сайта, он не будет опубликован без объяснения причины отказа в публикации. Если в вашей статье имеются ссылки, или статьи будут носить рекламный характер, то Вам сюда.
Защита авторских прав!
Присланный вами материал не должен нарушать авторских прав. Если это ваш материал, укажите ваше имя, и оно будет опубликовано в статье. В случае, если вы являетесь правообладателем и заметили, что размещенный на сайте материал нарушает ваши авторские права, напишите нам, этот материал будет немедленно удален с сайта. В письме приложите доказательства того, что вы являетесь автором материала или правообладателем.
По вопросам размещения пишите письма на email — [email protected]